Сотрудникам Института цитологии и генетики СО РАН удалось установить, что ионы железа могут выполнять функцию фармакологических шаперонов — низкомолекулярных соединений, которые участвуют в исправлении потенциального вреда, возникающего из-за нарушений в белках вследствие различных мутаций.
Целый ряд наследственных форм психических расстройств и нейродегенеративных заболеваний, как широко известных (болезнь Паркинсона, некоторые формы шизофрении), так и более редких, при разной симптоматике имеет и общие черты. Прежде всего, это возникающие по разным причинам нарушения функций белков, участвующих в коммуникации между нейронами. По очевидным причинам изучать, как именно сказываются на работе клеток эти нарушения на реальных пациентах во многом затруднено. Поэтому сотрудники сектора генетических коллекций нейропатологий ИЦиГ СО РАН проводят такие исследования на молекулярных моделях, созданных с помощью передовых генетических технологий.
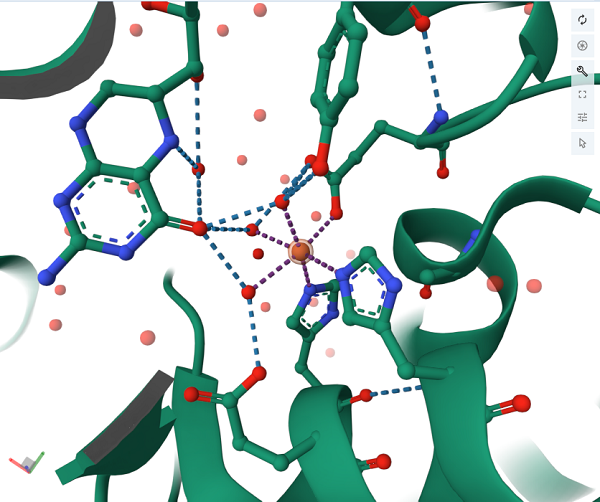
Пространственная (3D) структура активного центра фермента фенилаланингидроксилазы с демонстрацией связей ионов железа с азотами двух остатков гистидина и кислородом остатка глутаминовой кислоты. Структура построена на основе данных ренгеноструктурного анализа
«В частности, мы изучаем мутации в ферментах, которые могут быть одной из причин развития психических и нейродегенеративных заболеваний у человека, причем, достаточно тяжёлых. Например, таких форм депрессии, при которой широко используемые в психиатрии антидепрессанты оказываются неэффективными и даже ухудшают состояние пациента», — рассказал заведующий сектором главный научный сотрудник ИЦиГ СО РАН д.б.н. Александр Куликов.
Большинство мутаций связано с нарушением трехмерной структуры белка, которую еще называют укладкой или фолдингом. «Нормальный белок, фермент постоянно подвергается тепловым ударам молекул воды и это ведет к его постепенному разрушению (денатурации). Это обычный жизненный цикл, но вследствие нарушений структуры снижается устойчивость белков к подобным воздействиям, они разрушаются заметно быстрее. В результате, их содержание в организме снижается, и они уже не могут выполнять свою функцию в полном объёме», — пояснил Александр Куликов.
Некоторое время назад было установлено, что шапероны способны встроиться и стабилизировать структуру таких белков, повысив их устойчивость к внешним воздействиям. Это вызвало большой интерес к подобным соединениям как к потенциальным кандидатам на роль новых лекарственных препаратов. Но поскольку, до сих пор учёные не смогли выяснить, каким именно образом действуют шапероны, поиск таких кандидатов сильно затруднен.
В ИЦиГ СО РАН выяснили, что подобными свойствами обладают ионы железа. «Сами по себе они не могут выступать кандидатом на роль лекарства, поскольку очень ядовиты для клеток мозга. Но, благодаря тому, что железо создает комплексные соединения со структурой белка, его ионы являются удобной моделью для изучения того, как все же работает шаперон», — отметил Куликов.
Это и стало главной задачей нового исследовательского проекта, поддержанного грантом Российского научного фонда. Участники проекта намерены выяснить действие стабилизирующих эффектов ионов железа и, возможно, других металлов или соединений на два фермента, которые участвуют в метаболизме ключевых медиаторов мозга — серотонина и дофамина.
Теперь у учёных есть три года, чтобы детально изучить и описать на примере этих ферментов, какие именно молекулярные воздействия позволяют стабилизировать их структуру с помощью шаперонов и как они протекают. Имеющаяся на сегодня информация позволяет предполагать, что механизмы работы таких соединений во многом универсальны, а значит, данные полученные в ходе изучения одного из них (ионов железа) можно будет экстраполироваться и на другие. Это облегчит поиск подобных соединений, среди которых в дальнейшем можно будет выбирать кандидатов на роль новых эффективных лекарств от самых разных заболеваний, вызванных подобного рода мутациями в генах.
Источник: пресс-служба ИЦиГ СО РАН.