http://www.ras.ru/news/shownews.aspx?id=486c7430-cae8-404a-8f9b-b4424cd54e53&print=1
© 2024 Российская академия наук
Около половины известных антибиотиков нацелены на аппарат трансляции клеток-мишеней и до сих пор представляют важнейшее значение для медицины. Проанализировав базы данных секвенированных геномов млекопитающих, коллектив сотрудников Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН обнаружил уникальное по структуре семейство пролин-богатых антимикробных пептидов (ПБ-АМП) у жвачных парнокопытных, способных эффективно блокировать работу бактериальных рибосом. Работа опубликована в престижном журнале Nature Communications.
Широкое распространение и эволюция устойчивых к антибиотикам возбудителей инфекционных заболеваний является серьёзной медицинской проблемой в 21 веке. Ингибиторы рибосомы нового поколения должны обладать высокой эффективностью в отношении широкого спектра патогенов и отличными от известных антибиотиков механизмами действия, что снизит вероятность проявления перекрёстной резистентности к ним. Одним из классов искомых соединений являются ПБ-АМП, выполняющие защитную функцию в системе врождённого иммунитета у многих животных.
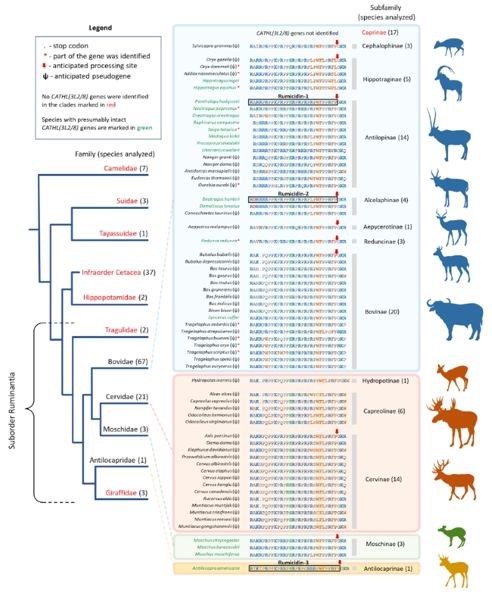
Анализ геномов парнокопытных на предмет наличия генов, кодирующих румицидины
В данной работе представлены результаты биоинформатического поиска и анализа биоразнообразия нового семейства ПБ-АМП млекопитающих, названных румицидинами. Значительное распространение соответствующих ортологичных генов среди жвачных предполагает их появление до разделения вилороговых и других жвачных (кроме оленьковых) на рубеже олигоцена и миоцена. Использование комплексного подхода, включающего биохимические исследования, анализ отобранных устойчивых штаммов бактерий, а также методы структурной биологии, позволило установить особенности механизма антимикробного действия румицидинов. Благодаря множественным контактам пептида в выходном тоннеле и пептидилтрансферазном центре рибосомы, румицидины способны эффективно ингибировать стадию элонгации трансляции у бактерий. Ключевой структурной особенностью румицидинов является наличие консервативной диады Trp23-Phe24, которая образует ряд ключевых взаимодействий с 50S субъединицей в области сужения выходного тоннеля.
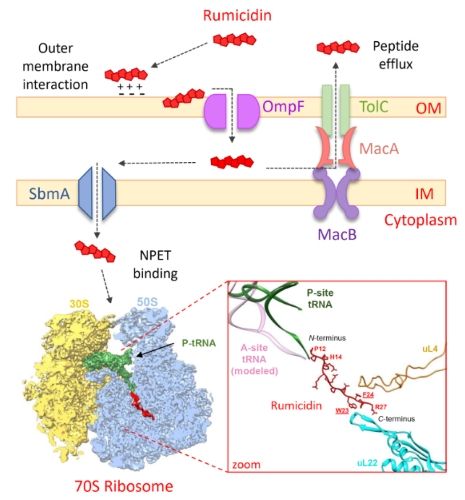
Механизм взаимодействия румицидинов с бактериальной клеткой-мишенью
Результаты скрининга биологической активности румицидинов свидетельствуют об их низкой токсичности и значительной антибактериальной селективности, что является существенным преимуществом перед многими другими мембраноактивными катионными АМП. Румицидины обладают высокой активностью против микобактерий и ряда важных грамотрицательных бактерий, относящихся к так называемым ESKAPE-патогенам. Эффективность румицидинов была также доказана на модели летальной септицемии у мышей, вызванной E. coli. Полученные результаты показывают, что румицидины являются перспективной основой для конструирования пептидных антибиотиков нового поколения.
Работа выполнена при поддержке грантов РНФ № 21-74-00100 и № 22-14-00380.
Текст: Артём Григоров.
Источник: ИБХ РАН.